
Los equipos microinformáticos necesitan energía eléctrica para funcionar, pero cuando queremos que dicho dispositivo sea portable y no tengamos que tenerlo conectado a la red eléctrica, necesitaremos proveerlo de una batería que le proporcione dicha corriente eléctrica.
Uso de las baterías
Una batería (battery), también conocida como batería eléctrica, acumulador eléctrico, acumulador o pila recargable, es un dispositivo diseñado para almacenar energía eléctrica mediante procesos electroquímicos. Esta energía puede ser liberada posteriormente en forma de corriente continua y, a diferencia de las pilas convencionales, las baterías pueden ser recargadas repetidamente para su reutilización.
Es importante diferenciar las baterías de las pilas no recargables, que, una vez agotadas, no permiten restaurar su energía eléctrica.
Podemos encontrar baterías en los siguientes dispositivos:
- Portátiles.
- Móviles y tablets.
- Sistemas de alimentación ininterrumpida (SAI).
Funcionamiento de las baterías
Las baterías funcionan a través de procesos electroquímicos que involucran reacciones de oxidación y reducción (redox). Durante la descarga, las reacciones químicas convierten la energía química almacenada en energía eléctrica, mientras que durante la carga, el flujo de energía eléctrica invierte esas reacciones, almacenando energía química para su uso posterior.
Para entender el proceso necesitamos conocer la base de la electricidad, que consiste en el movimiento de los electrones a lo largo de un conductor. Recordamos las siguientes definiciones:
- Electrones: son la carga negativa de los átomos.
- Iones: son los átomos que han perdido electrones (cationes) o que han ganado electrones (aniones).
Componentes
Las baterías se componen de los siguientes componentes internos:
- Electrodo negativo: sustancia que libera electrones a través de una reacción de oxidación.
- Electrodo positivo: sustancia que acepta electrones mediante una reacción de reducción.
- Electrolito: medio químico que permite el movimiento de iones entre los electrodos.
- Membrana: capa fina y porosa que se sitúa entre los electrodos evitando que se toquen y no produzcan cortocircuitos, pero permitiendo el paso de los iones.
- Celdas: cada celda se compone de ánodo, cátodo, electrolito y membrana, las celdas se combinan para que trabajen juntas y configurar la capacidad total de la batería.
Y los siguientes componentes externos:
- Bornes, polos o terminales: son los terminales eléctricos metálicos externos a la batería donde conectar el circuito externo que permite el flujo de la corriente eléctrica que produce la batería.
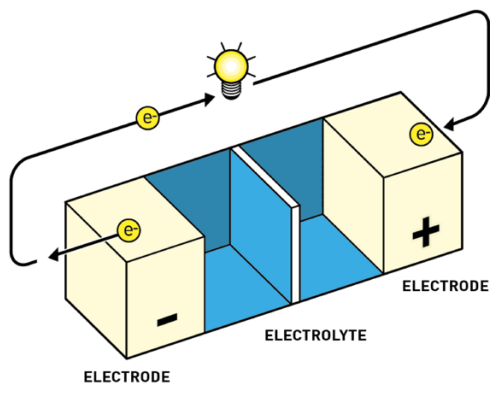
Partes de la batería (de NobelPrize)
Proceso de descarga (suministro de energía)
Al conectar un dispositivo consumidor de energía a los bornes externos de la batería, esta suministra la energía almacenada mediante el siguiente proceso:
- Circuito externo: los electrones fluyen desde el electrodo negativo hacia el electrodo positivo a través del circuito exterior, generando la corriente eléctrica que alimenta el equipo.
- Circuito interno: los iones (con carga positiva) se desplazan a través del electrolito y la membrana separadora desde el electrodo negativo hacia el electrodo positivo para mantener el equilibrio eléctrico.
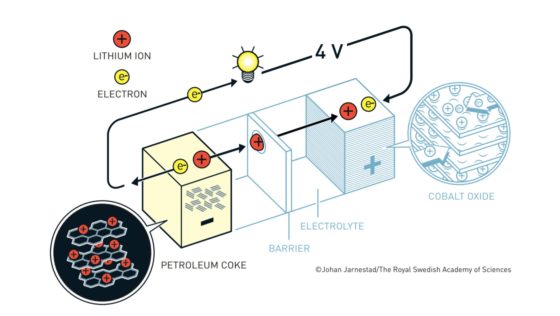
Proceso de descarga de la batería (de NobelPrize)
Proceso de carga (almacenamiento de energía)
Al aplicar una fuente de energía a los bornes exteriores de la batería, se vuelve a regenerar su almacenamiento de energía mediante el siguiente proceso:
- Circuito externo: el voltaje superior de la fuente de energía externa con respecto al voltaje de ese momento de la batería, fuerza a los electrones a viajar por el circuito externo en sentido contrario, desde el electrodo positivo hacia el electrodo negativo.
- Circuito interno: los iones (con carga positiva) son obligados a migrar de vuelta a través del electrolito y la membrana, desde el electrodo positivo hacia el electrodo negativo.
Vídeo explicativo
En el siguiente vídeo podemos ver una sencilla explicación del proceso, pero hay que tener en cuenta que normalmente se suele poner el ánodo (electrodo negativo) a la izquierda y en el vídeo aparece a la derecha; y también que los electrones no fluyen por el circuito externo al volver a cargar la batería.
Cómo funciona una batería (Vídeo)
Tipos de baterías
Podemos encontrar los siguientes tipos de baterías en función del dispositivo donde vaya a ser utilizado.
- Baterías de móvil o tablet.

- Baterías de portátil.

- Baterías de SAI.

- Pilas recargables para periféricos inalámbricos.

Tecnologías de las baterías
Según el material del que se fabriquen los componentes internos de la batería, podemos encontrar diferentes tipos de tecnologías. Vamos a detallar los más usuales que encontramos para los equipos microinformáticos.
Baterías de Níquel
Las podemos encontrar en un formato más antiguo utilizando Níquel-Cadmio (Ni-Cd) y en un formato posterior con Níquel-Hidruro Metálico (Ni-MH). Fueron las primeras que se utilizaron en dispositivos móviles y portátiles.
Ventajas:
- Resisten muchos ciclos de carga/descarga.
- Funcionan bien en entornos extremos de frío y calor.
- Recarga rápida.
Desventajas:
- Efecto memoria, pierden capacidad si no se descargan completamente antes de recargarlas.
- Las que contienen cadmio son más peligrosas, ya que es un material tóxico y contaminante.
- Más voluminosas y pesadas que las tecnologías modernas.
Baterías de Litio
Las podemos encontrar en Litio (Li-Ion) con el electrolito líquido o en Polímero de Litio (Li-Po) con el electrolito en gel. Son más actuales y sus ventajas han hecho que desplacen a las de Níquel-Cadmio. Las encontramos en dispositivos móviles y portátiles.
Ventajas:
- Alta densidad de energía, mayor capacidad en tamaños pequeños.
- Por peso.
- Baja autodescarga cuando no están en uso.
- Soportan ciclos de carga parciales sin afectar la vida útil. En realidad, los fabricantes recomiendan mantener la carga entre el 20% y el 80%, pero haciendo cargas de 100% cada cierto tiempo para equilibrar la batería (leer más).
- Las de Polímero de Litio tienen menos riesgo de fugas y explosión y son más ligeras.
Desventajas:
- Sensibles al calor y la sobrecarga, por lo que necesitan circuitos de protección.
- Degradación con el tiempo, pierden capacidad con los ciclos de carga y descarga.
- Las de Polímero de Litio tienen menos densidad de energía y son más costosas.
Baterías de Plomo-Ácido
Las baterías de Plomo-Ácido Reguladas por Válvula (VRLA - Valve Regulated Lead Acid) son las más utilizadas en SAIs (así como en vehículos eléctricos y almacenamiento de instalaciones solares) debido a su confiabilidad, bajo costo y mantenimiento reducido.
Las podemos encontrar en formato AGM, en las que el electrolito es líquido, o Gel, en las que el electrolito es gel.
Ventajas de las baterías AGM:
- Ideales para entregar picos altos de corriente en poco tiempo.
- Mayor número de descargas en su vida útil.
- Menos susceptibles a fugas.
Ventajas de las baterías Gel:
- Mayor profundidad de descarga, podremos apurarlas más en la descarga.
- Mejor funcionamiento en altas temperaturas.
- Menos susceptibles a la sulfatación de los bornes.
Baterías de Litio-Hierro-Fosfato
Las baterías de Litio-Hierro-Fosfato (LiFePO4) son una evolución de las de Litio para su uso en SAIs (así como en vehículos eléctricos y almacenamiento de instalaciones solares), con mejoras en la gran capacidad de almacenamiento respecto a las VRLA.
Ventajas:
- Mayor densidad de energía.
- Ciclo de vida más largo.
- Mayor profundidad de descarga.
- Mayor eficiencia, menos energía se pierde en forma de calor durante la carga y la descarga.
- Menos susceptibles a fugas.
- Mayor tolerancia a temperaturas extremas.
- Carga más rápida.
Desventajas:
- Mayor costo.
- Necesidad de un sistema de gestión electrónico de batería más complejo.
Parámetros eléctricos de las baterías
Los parámetros eléctricos que están asociados a las baterías y que debemos conocer son los siguientes:
- Tensión: Son los voltios que va a proporcionar la batería (V).
- Intensidad: Es la intensidad máxima que puede suministrar la batería en un instante concreto y se mide en amperios (A).
- Capacidad: Es la energía que puede almacenar la batería y se mide en amperios/hora (Ah) o miliamperios/hora (mAh), es decir, el número de amperios que puede proporcionar en una hora.
Por ejemplo, por comparar dos baterías diferentes, en la batería de un portátil al azar podemos encontrar una tensión de 7.6V y 3950mAh, mientras que la batería de un SAI de oficina encontraremos 12V y 9Ah.
Acomplamiento de baterías
Las baterías las podemos acoplar entre ellas para aumentar sus características. Esto lo podemos encontrar en SAIs empresariales con una gran capacidad, o cuando unimos varias pilas recargables en un mismo dispositivo. Suponiendo que son similares las baterías, podemos realizar estos dos acoplamientos:
- Acoplamiento en serie: El borne positivo de una batería se conecta con el borne negativo de la siguiente. La tensión resultante es la suma de las tensiones de cada batería, mientras que la capacidad es la misma que una de ellas.
- Acoplamiento en paralelo: Se unen todos los bornes positivos por un lado y todos los bornes negativos por otro. La tensión resultante es la misma que la tensión de una de ellas, mientras que la capacidad resultante es la suma de la capacidad de cada una de ellas.
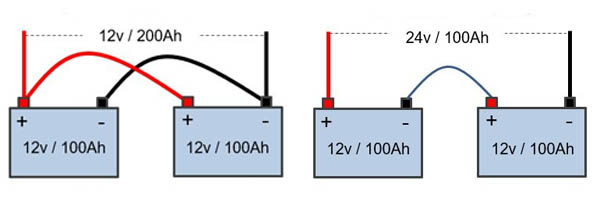
Acoplamiento en paralelo (izquierda) y en serie (derecha). Imagen de Coelectrix.
Bibliografía
- Así funcionan las baterías de Litio. Cultura científica.
La batería del equipo microinformático escrito por Rafa Morales está protegido por una licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional
